化学笔记
本文最后更新于 2 个月前
前言
不满于乱七八糟的化学课本,我决定自己整理一下知识点。
(怎么第二学期还得考上学期的内容啊啊我不会)
电子版有个好处就是可以随意增减,缺点就是教室没有私人电脑,只有私人占有的一体机。
算了权当复习吧。
【注】这是考点的备注
一、从物质分类到定量研究
1.物质的再分类
图
1.1 同素异形体
由同种元素形成的性质不同的单质
例如O2与O3;金刚石和石墨;白磷和红磷
他们的物理性质不同,化学性质基本相同。
1.2 混合物——物质的分散系
1.2.1 溶液
1.2.2 胶体
(1)胶体的性质
- 介稳性
- 丁达尔效应
- 电泳
- 聚沉
(2)胶体的分类
(3)胶体的制取
(4)胶体的提纯
1.2.3 浊液
1.3 氧化物
(1)碱性氧化物
(2)酸性氧化物
(3)不成盐氧化物
(4)两性氧化物
1.4 盐
2.物质的计量
3.物质的分离提纯
3.1 过滤结晶
3.2 蒸馏
3.3 萃取、分液
(1)提纯溴水中的溴
(2)提纯碘水中的碘(反萃取法)
4.物质的检验
4.1 NH+4
4.2 Cl−
4.3 SO2−4
4.4 CO2−3、HCO−3
4.5 Na+、K+
4.6 Al3+、AlO−2 ([Al(OH)4]−)
二、氧化还原与离子反应
1.氧化还原反应
1.1 定义
有电子转移的化学反应(共用电子对偏移或电子得失)
体现在化合价升降。
例如: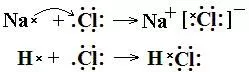
升失氧做还原剂,降得还做氧化剂,什么剂有什么性。(指的是得失电子)
【注】
特殊物质化合价
亚氨锂 Li2−3NH
氨基锂 Li−3NH2
氮化铝 Al−3N
硫代硫酸钠 Na2+2S2O3
草酸根 +3C2O2−4
氰化氢 H+2C−3N
氢化铜 +1Cu−1H
氮化硅 +4Si3−2N2
黄铜矿 +2Cu+2Fe−2S2
高铁酸钾 K2+6FeO4
铁酸根 (8−n)FeOn−4