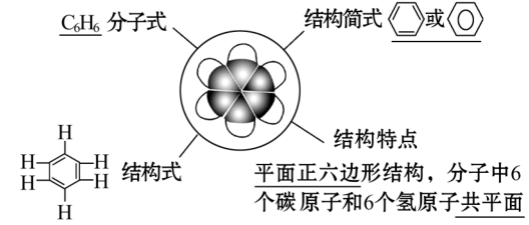
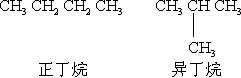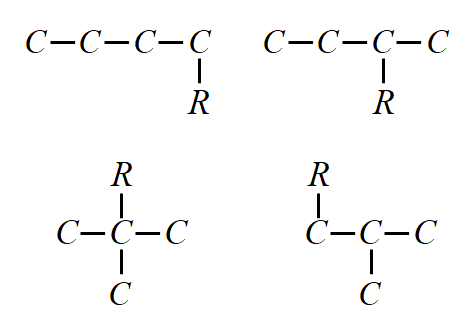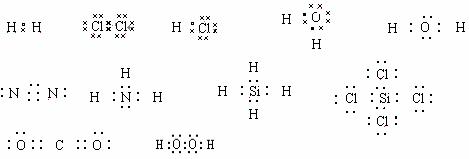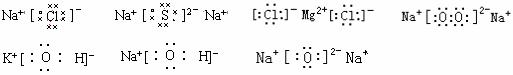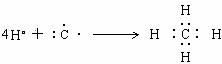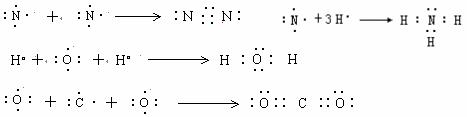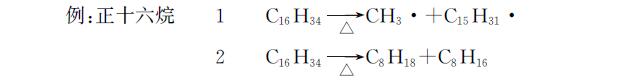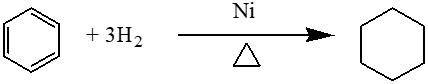高中有机化学笔记
本文最后更新于 2 个月前
前言
课本上有机化学部分分散在必修二和选修,十分奇怪
而且我们老师讲的感觉好乱
好吧,乱就整理嘛
于是就有了这篇文章
希望放假时间里能写完
【注】这是考点的备注
这篇文章才不管什么必修选修,直接放在一起了.
内容来自网络,由我自己整理,雷同巧合.
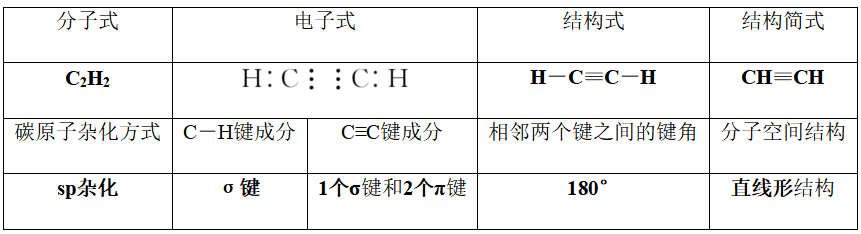
一、烃
(一)有机物的基础知识
1.定义
有机化合物简称有机物,通常指含碳元素的化合物.
【注】CO、CO2、H2CO3、碳酸盐;金属碳化物、氰化物、硫氰化物以及碳化硅
属于无机物,因为他们的性质与无机物相似
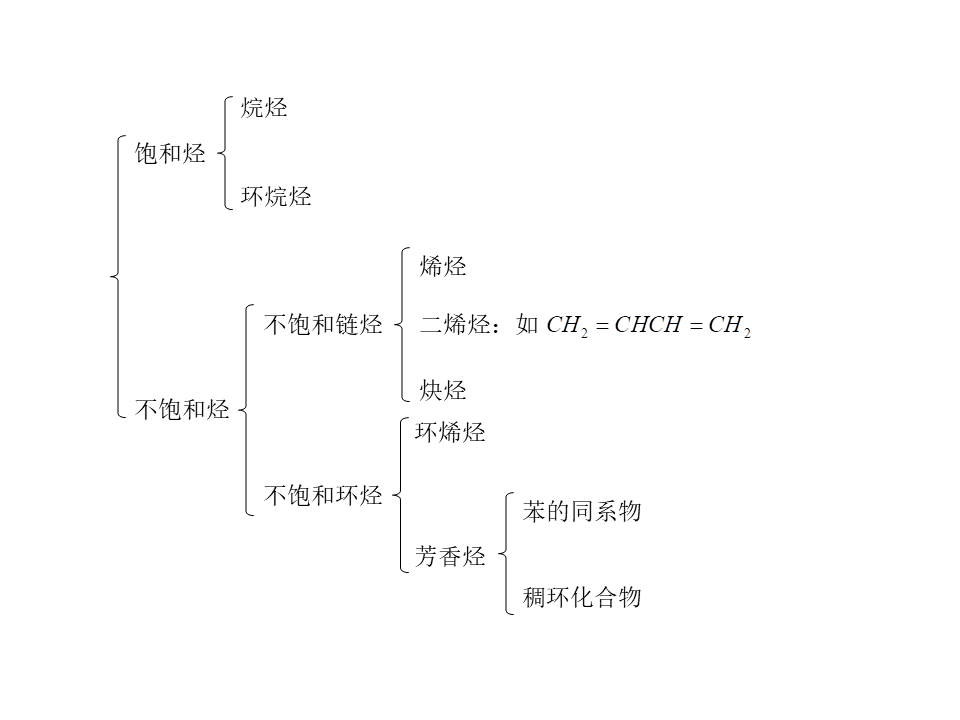
2.分类
(1)按碳的骨架分类
①是否含有环
②按是否含有苯环
③是否含有不饱和键
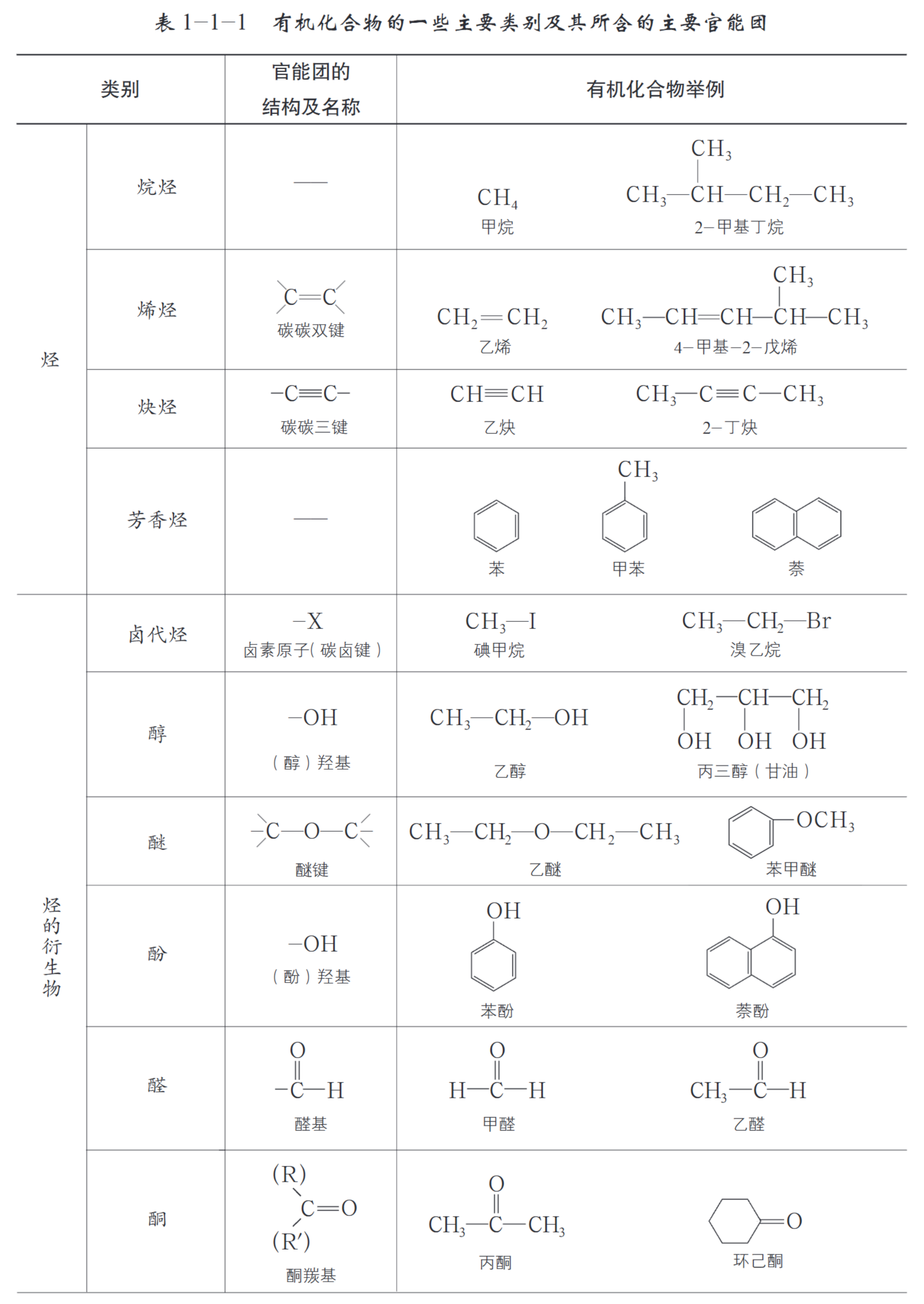
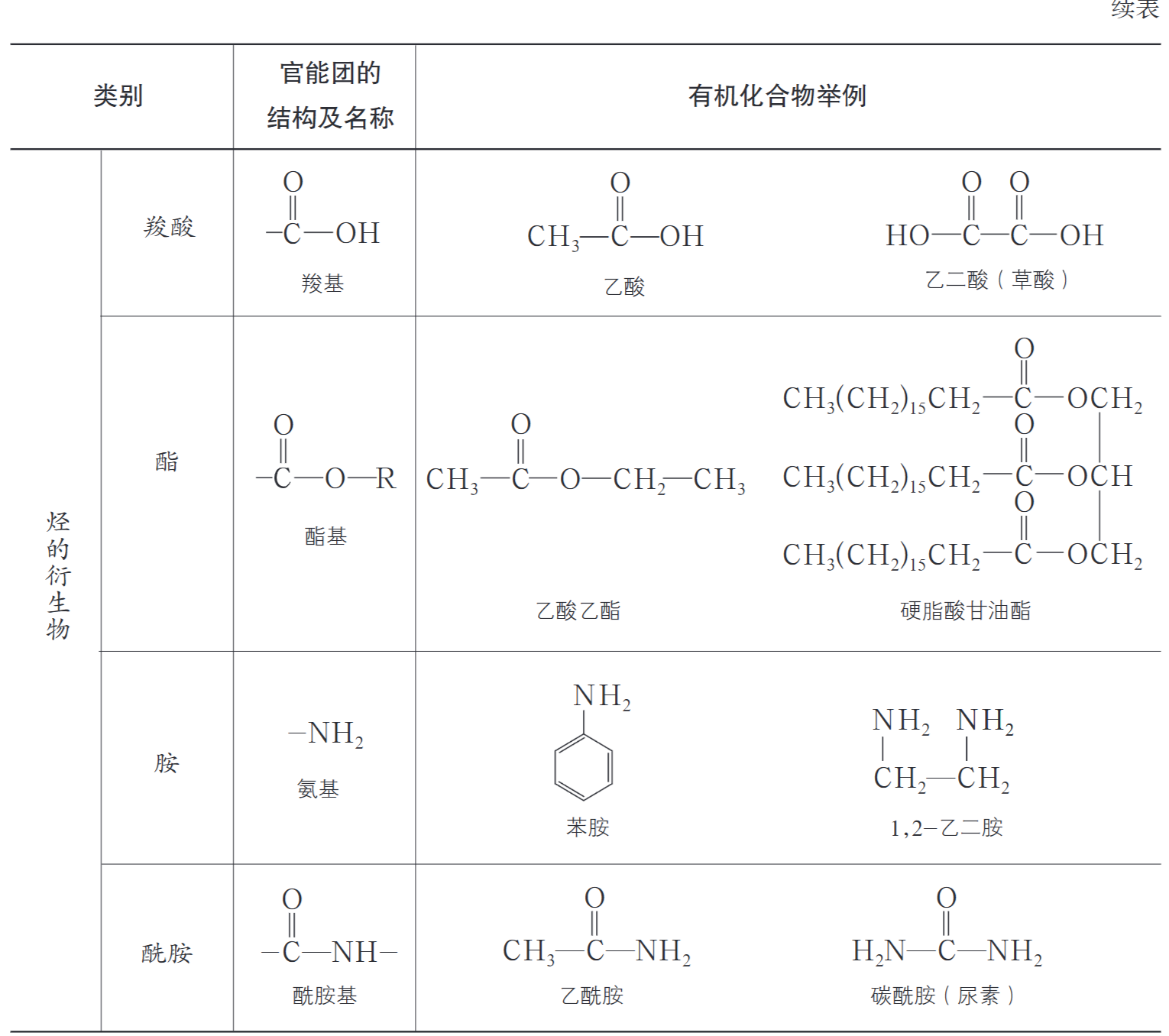
(2)按官能团分类
官能团:有机物分子中决定有机物性质的原子团
3.同系物
(1)定义
结构相似,在分子组成上相差一个或多个CH2的物质.其物理性质有规律的变化,化学性质相似.
(2)特征
①必须结构相似:官能团种类和数目相同,组成通式相同.
②随着碳原子↑
相对分子质量↑,分子间作用力↑,熔沸点↑
【注】
a.经典栗子:
环烷烃和单烯烃都满足通式CnH2n,但是官能团不同,不属于同系物
b.烷烃有无支链都算同系物:如甲烷与新戊烷属于同系物,其结构相似.
4.同分异构现象
4.1定义
二种或二种以上的化合物,具有相同的化学式,但结构和性质均不相同,称为同分异构现象.
【注】有机物中与无机物中也存在同分异构现象,如氰酸铵NH4CNO与碳酰胺CO(NH2)2(尿素)
4.2分类
1 结构异构:
- 碳骨架异构(碳链异构)
- 官能团异构
- 位置异构
- 类型异构
2 立体异构:
- 顺反异构
- 对映异构(旋光异构)
(1)碳骨架异构
碳原子排列顺序不同
(2)官能团异构
官能团位置不同:位置异构
官能团种类不同:类型异构
(3)顺反异构
在含碳碳双键或环状结构的有机物中,因旋转障碍产生的同分异构体.
(4)对映异构
具有手性碳原子的有机物中可能出现.
4.3数量的判断
(1)基元法
根据烃基的异构体数判断
| 基团 | 异构体个数 |
|---|---|
| 甲基 | 0 |
| 乙基 | 0 |
| 丙基 | 2 |
| 丁基 | 4 |
| 戊基 | 8 |
使用举例:丁醇
即C4H9−OH,因为丁基有四种同分异构体,所以丁醇也有四种.
(2)等效氢法
相同环境的的氢称为等效氢,当取代基分别取代它们时,得到的化合物相同.
①同—C上的H是等效的;
②同—C上所连的—CH₃上的H是等效的;
③同一分子中处于轴对称或中心对称位置上的H是等效的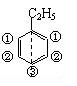
(3)替代法
异构体不改变不饱和度,所以可以有:
C=C 替代为 单键环
C=O 替代为 C=O + −O−
C≡C 替代为 2个C=C / 两个单键环
(4)侧链重组法
芳香族化合物主要是侧链异构时,依次考虑一个、两个…取代基
(5)等效法
有机物中某些元素等效,异构体数相等,如C6H4Cl2与C6H2Cl4异构体数目相等.
5.不饱和度(Ω)
5.1定义
有机物分子不饱和程度的量化标志.
因为对于n个碳原子的有机物,饱和时氢原子应有2n+2个,最少缺两个氢,所以有
每减少两个一价原子,分子就多一个不饱和度.
比如CH3−CH3 → CH2=CH2 → CH≡CH
Ω就是0→1→2
5.2计算
(1)根据结构判断
| 结构 | 不饱和度Ω |
|---|---|
| 双键 | 1 |
| 三键 | 2 |
| 脂肪环 | 1 |
| 苯环 | 4 |
苯环可以看作一个脂肪环加上三个双键而得.
(2)通过分子计算
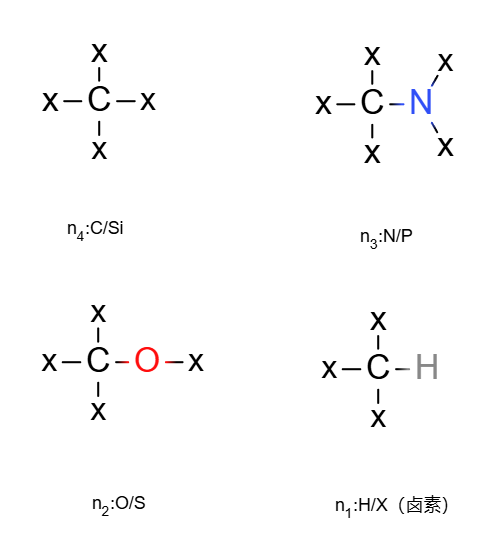
①含碳族元素、氮族元素、氧族元素、卤素与氢元素
Ω=1+n4+12(n3−n1)碳族元素作为中心原子,需要补上四个氢才能饱和
氮族元素帮倒忙,需要多补一个氢
氧族元素不帮忙,需要补的氢原子数不变
卤素与氢元素帮忙,减少一个需要补的氢
没有被氢补上的就是不饱和的
②简化版本
当没有氮族元素时,式子简化如下:
或者写成这样更好看
Ω=1+C+H25.3应用
同分异构体之间的不饱和度相等
6.结构与组成的表示
①分子式
分子式是用元素符号表示单质或化合物分子组成的式子.分子式可以反映物质的组成及相对分子质量,但不关心具体的结构.
②最简式(实验式)
最简式仅表示为组成物质分子中原子的最简整数比,不同的化合物可以有相同的最简式.
③电子式
来源:https://www.hxzxs.cn/plus/view.php?aid=3989
电子式是一种化学用语,它是用元素符号和外层电子来表示的,元素符号表示除最外层电子以外的所有部分,而最外层电子可用“·”、“′”、“°”来表示.用电子式可表示原子、离子、原子团;还可以表示离子化合物、分子或共价化合物的结构,离子化合物、分子或共价化合物的形成过程.
一、怎样书写电子式
1.原子电子式的书写要符合洪特规则,这有利于掌握洪特规则,了解最外层的未成对电子和孤对电子的情况,有利于学习化学键.
由于原子最外层为nsnp,一个s轨道,三个p轨道,共可容纳8个电子,故可将元素符号的上下左右看成四个轨道,再分别按洪特规则填以实有的电子数.现以第2周期八种元素为例,其电子式的写法如下:
这里注意的是,镁、铝、硅、磷、硫原子的电子式不应该写成如下形式:
2.离子电子式的书写主要是阴离子要有方括号和离子电荷.离子电荷标在右上角,且数字在前,正负号在后.如果标在正上方,且正负号在前,符号在后,则是标能化合价符号了.阳离子除氨根离子外,一般只在元素符号的右上角标出数字和正号,而不再标出最外层电子.
主族元素的原子,除氢原子外,一般最外层都是8电子的稳定结构.
3.分子或共价化合物电子式的书写,要注意共价键是非极性键还是极性键;若果是非极性键,则共用电子对应处于两原子的中间;若是极性共价键,则共用电子对应偏向于吸引电子能力大(即非金属性较强)的原子,而偏离吸引电子能力小(即非金属性较弱)的原子.
还要注意两原子间是共用一对电子,还是共用两对、叁对电子.如N2和CO2分子的电子式书写容易出错,可从下列书写方式加深对它们电子式的理解.
从以上形成共用电子对的过程可知,N2分子中是共价叁键,而非两个三电子键.
对于CO2分子情况要复杂一些,主要是C原子会通过sp3杂化形成4个等同的电子,所以出现4个成单电子,这样CO2分子中每个O原子都能与C原子形成两对共用电子对,还有两对孤对电子.
这样就不会将N2和CO2分子的电子写成如下形式:
对于CO分子,从下图示可知除有两对共用电子对外,还有一个配位键,O原子提供了一对孤对电子,C原子提供一个空轨道.
4.离子化合价电子式的书写要注意阳离子的外层电子不再标出,只在元素符号右上角标出正电荷,而阴离子则要标出外层电子,并加上方括号,在右上角标出负电荷.还要注意阴离子电荷总数与阳离子电荷总数相等,因为化合物本身是电中性的.
5.用电子式表示单质分子或共价化合物的形成过程
用电子式表示形成过程,左边要有反应物的原子的电子式,右边要有生成物的分子的电子式,中间用箭号连接.通过共价键形成的,原子一般有未成对电子,生成物要有共用电子对,不能有离子符号出现.
6.用电子式表示离子化合物的形成过程
用电子式表示由离子键形成离子化合物过程,一定要在右边用阴阳离子来表示物质.
因此,用电子式表示形成过程,首先要弄清是通过离子键形成离子化合物,还是用共价键形成共价化合物和单质,然后才能按照各自的方法来书写电子式.
④结构式
结构式,是用元素符号和短线表示化合物(或单质)分子中原子的排列和结合方式的化学式,是一种简单描述分子结构的方法.结构式可以完整地绘出分子内每个原子间的化学键.
⑤结构简式
结构简式是结构式的简化版本,遵循以下规则:
a.单键的短线可以省略,双键、三键不省略
b.醛基缩写为−CHO,羧基缩写为−COOH(懒得找图了,参见前面官能团)
⑥键线式
只用键线来表示碳架,每个端点和拐角处都代表一个碳.
1、画出分子骨架:画出除碳-氢键外的所有化学键.通常所有的氢原子及碳-氢键均省略不画,碳原子用相邻的线的交点表示,一般情况下不用注明.
2、环形结构用相应边数的多边形来表示.
3、苯的结构可用两种方法表示.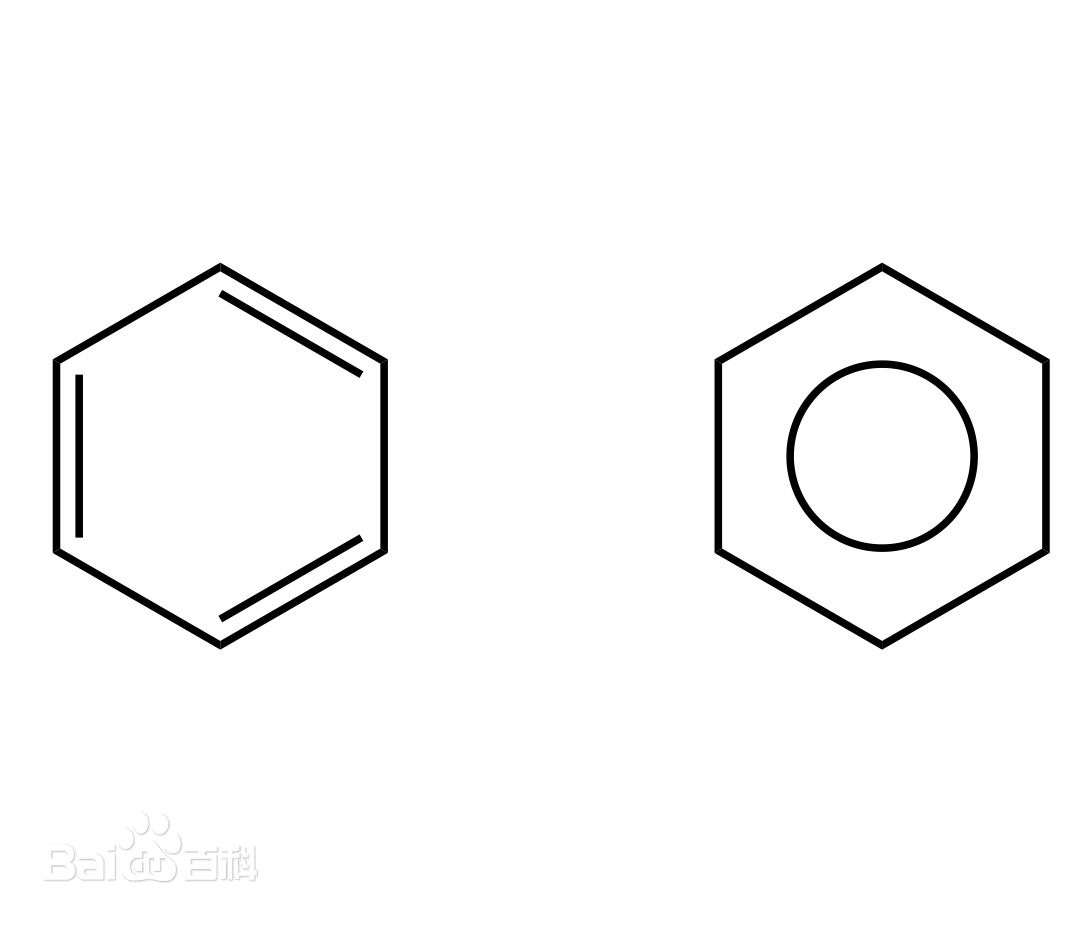
4、官能团需要标明.标明时可以缩写(如-CN),也可以不缩写(如-C≡N).
5、杂原子(非碳、氢原子)不得省略,并且其上连有的氢也一般不省略.
6、氢键用虚线表示.
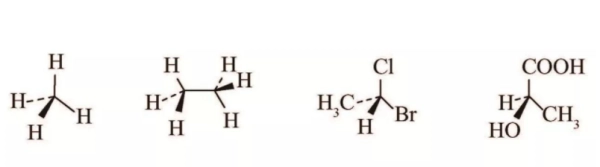
⑦立体结构式(以楔形透视式为例)
每个碳原子的4条连线中,2条为实线,另2条分别是实心的楔形和虚线的楔形或虚线.看楔形式首先找出2条实线,并意识到由这2条实线确定的平面的存在,则会出现一个立体形象,实心的楔形表示的原子或基团在平面的前面,虚线或虚线的楔形表示的原子或基团在该平面的后面.
⑧球棍模型
⑨比例模型(空间填充模型)
见上图.
7.有机物的命名
7.1 烷烃的命名
来源:http://dec3.jlu.edu.cn/webcourse/t000102/jiaoxue.htm
一、俗名
有机化合物的命名,常根据其来源、用途或由于结构过于复杂等原因,而采用“俗名”,如酒精、醋酸、吗啡、叶绿素、维生素 B12等.
二、普通命名法
本法适用于结构简单的烷烃.
(1) 名称字尾为烷,前面加天干十字 ( 甲、乙、丙、丁、戊、已、庚、辛、壬、癸 ) 代表碳原子的数目.数目再多,则以中文数字表示.例如:

对于无支链的烷烃,有时在名称前加“正”或“ n ”,以区别有支链的异构体.
(2) 具有 (CH3)2CH— 端链时,在名称前加一“异”字;具有 (CH3)3C — 端链时,则在名称前加一“新”字.例如:
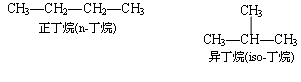
这种命名法的适用范围有限,对于结构比较复杂的烷烃,就难以用这种命名法命名,必须采用系统命名法.
三、系统命名法
1892 年,日内瓦国际化学会议首次拟定了一个系统命名原则,以后经过国际纯粹及应用化学联合会 (IUPAC) 定期作了几次修改,所以也称为 IUPAC 命名法.根据这个命名原则,结合我国文字的特点,制定了我国的系统命名法,在 1960 年颁布了“有机物质的系统命名原则”. 1980 年,又由中国化学会加以增减修订, 1983 年,出版了《有机化学命名原则》 (1980) 推荐使用.
在系统命名法中,对于无支链的烷烃,可省“正”字;对于带有支链的烷烃,则要把它看成为去掉支链后的母体烷烃的衍生物,然后再补充支链的名称.所谓支链,就是各种烷基 ( 相应的烷烃失去个氢原子而剩余的部分 ) ,其通式为 CnH2n+1— ,常以 R— 表示.常见烷基的结构及名称如下:
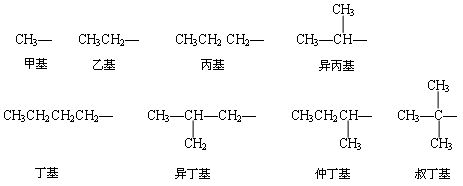
命名一个烷烃的结构,实际上就是描写出主链(母体)和支链(烷基)的具体情况,其步骤如下:
(1)选择结构中最长的、连续的碳链作为链,以相应于主链的烷烃作为母体,按照碳数目加以命名.例如:
主链上有 6 个碳原子,所以命名其母体为己烷.
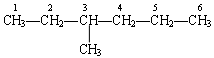
(2)当主链上连有取代基时,要对母体烷烃各个碳原子给予编号,以确定取代基的位次.给主链原子编号的原则是从靠近支链的一端开始,将主链上的碳原子依次编号为 1 、 2 、 3 、 4 、 5 、 6 ……标出其位次.位次号码与取代基之间用一半字线连接起来,写在母体化合物名称的前面.例如:
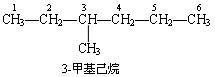
(3) 如果主链上连接有不止一个支链,根据最小编号顺序规则,主链的编号顺序应使支链位次尽可能低.例如:
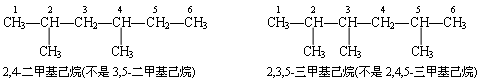
注意在上例中,当主链上有两个或多个相同的支链,则将它们全并在一起,并在其名称前用二、三等数字表示支链的数目.
(4) 若主莲上连接有不同的支链时,名称中支链前后的顺序,应按从简单到复杂的原则考虑.例如:
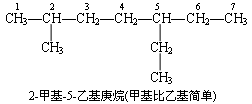
(5) 遇到较复杂的支链时,如支链上又有烷基取代,则须将支链再行编号 ( 从与主链相连的碳原子开始开始 ) ,然后补充支链上烷基的位次、名称及数目.例如:
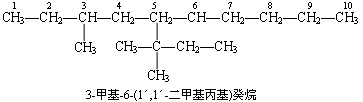
(6) 当分子中可找出两个合理的等长度的主链时,应优先选择具有较多支链的碳链为主链.例如:
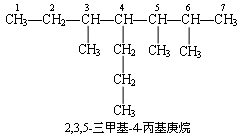
有机化合物的系统命名,要求达到准确反映结构及名称统一这两个目的,因此必须严格遵守制定的规则,即使标点符号也不得变动或忽略.
7.2 烯烃、炔烃的命名
烯烃的系统命名法基本上与烷烃相似,命名原则是:
(1) 选择一个包集 C=C 在内的最长碳链为主链,按主链碳原子的数目命名为某烯.如主链的碳原子数 10 超过个时,应烯字前加一“碳”字.
(2) 从靠近 C=C 的一端起,依次给主链上的碳原子编号,以 C=C 的两个碳原子中编号较小的阿拉伯数字表示 C=C 的位次,写于烯烃名称的前边,并用半字线隔开.如不会发生误会时,也可不标 C=C 的位次.若 C=C 正好在主链中央,并链碳原子则应从靠近取代基的一端开始编号.
(3) 取代基的命名与烷烃的命名方法相同,将位次、数目、名称分别写在烷烃名称前.例如:
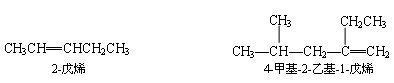
烯烃分子中去掉 1 个氢原子余下的和,称为烯基.常见的烯基有:
![]()
二烯烃命名时,选择含两个 C=C 双键的最长碳链主链,由距离 C=C 双键最近的一端开始,依次给主链碳原子编号,命名时遵循烯烃命名原则.例如:
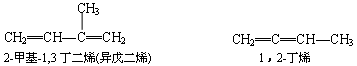
炔烃的命名方法与烯烃相同.例如:
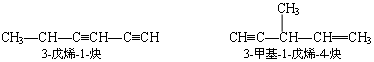
7.3 苯的同系物的命名
苯的同系物指苯分子中的氢原子被烃基取代的衍生物,如氢原子被烷基取代,其分子组成的通式为 CnH 2n-6. 命名方法是以苯环为母体,以烷基为取代基.例如:
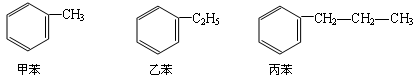
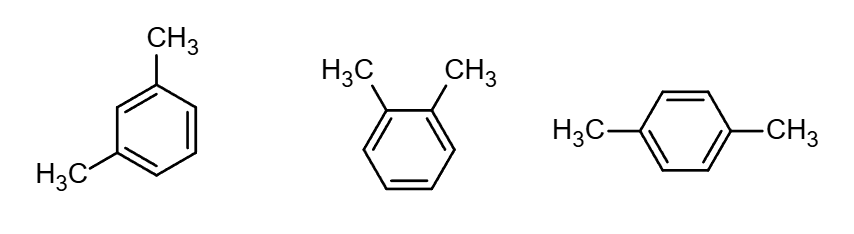
如环上有两个或两个以上烷基就会出现同分异构现象,命名时要标出取代基的位置.例如:
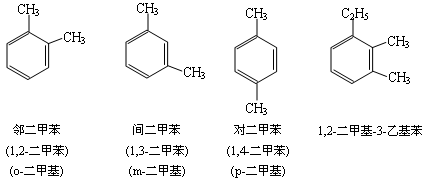
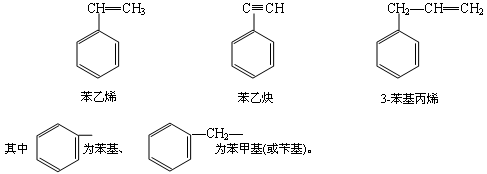
如苯环上连接有不饱和烃基时,通常以不饱和烃基为母体,苯基为取代基.例如:
【注】二烷基苯的同分异构体用“邻”“间”“对”表示(1,2、1,3、1,4)
三烷基苯则用“连”“偏”“均”表示(1,2,3、1,2,4、1,3,5)
7.4 烃的衍生物的命名
( 一 ) 醇的命名
1、普通命名法
对于结构比较简单的醇类可采用普通命名法,普通命名法扫烷基的普通名称命名,即在烷基后面加一个“醇”字,例如:
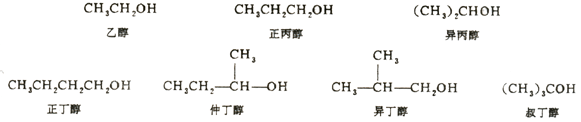
2、系统命名法
对于结构比较复杂的醇,常选择系统命名法.系统命名法的原则是:
(1) 选择含羟基的最长碳链为主链,按碳原子数称某醇;
(2) 从靠近羟基的碳原子一端开始依次给主链碳原子编号;
(3) 在写出命名时,把羟基所在的碳原子的位次写在某醇之前,取代基的位置和名称写在某醇的前面,并分别用半字线隔开.例如:
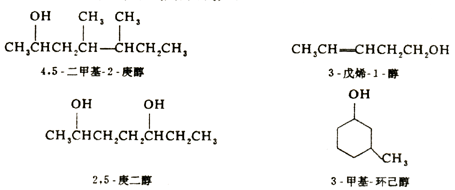
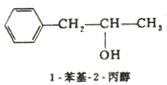
芳香醇命名时,以脂肪醇为母体,芳香烃基为取代基.例如:
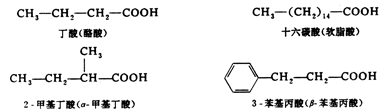
( 二 ) 羧酸的命名
羧酸的命名常用俗名或系统命名法.由于许多羧酸易被是从天然产物中分离得到的,因此通常根据来源而得俗名.例如,蚁酸、醋酸、油酸最初分别从蚂蚁、食醋和食油中得到,故而得名.许多高级一元羧酸最早从脂肪水解而得,故又称高级脂肪酸.
羧酸的系统命名原则与醛相似.命名时选择含羧基的最长碳链作主链,按主链碳原子数目称为某酸;从羧基碳原子开始用阿拉伯数字将主链编号,或用希腊字母 ( α、β、γ等 )从与羧基相邻的碳原子开始编号以确定侧链的位次.例如:
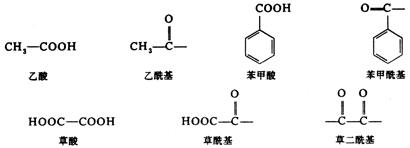
脂肪族二元羧本命名时,选择含两个羧基在磪的最长碳链作主链,称为某二酸.例如:
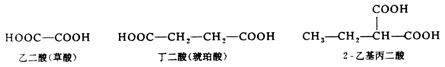
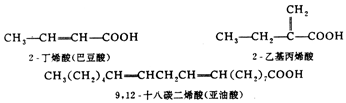
不饱和羧酸的命名,是选择含羧基和不饱和键在内的最长碳链为主链,称为某烯酸,并把不饱和键位置写在名称之前.如主链碳原子数多于 10个时,须在中文数字后加一个“碳”字.例如:
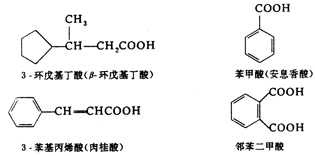
脂环族羧酸和芳香族羧酸的命名时,是以脂肪族羧酸为母体,把脂环和芳香环作为取代基.例如:
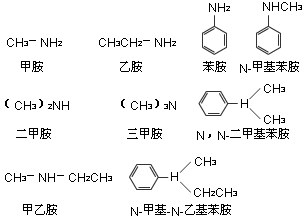
(三)胺的命名
1、简单胺的命名
一般是以胺为母体,在“胺”字前面写上烃基名称及数目,称为“某胺”,二级胺或三级胺的烃基相同时,称为“二某胺”或“三某胺”;烃基不相同时,简单的烃基在前,复杂的烃基在后.如果氮原子上同时连有芳香烃基和脂肪烃基时,可在脂肪烃基名称前加字母“ N”,用以表示该基团得连在氮上,而不是连在芳环上.例如:
2、比较复杂胺的命名 以烃为母体,以氨基为取代基命名.例如:
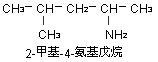
3、季铵类化合物的命名
季铵类化合物的命名,与无机化合物的命名相似.例如:氯化四甲胺、氢氧化四甲胺
8.研究有机物的一般步骤
分离提纯 → 元素定量分析 确定实验式 → 测定相对原子质量 确定分子式 → 波谱分析 确定结构式
8.1 分离提纯
蒸馏,重结晶,萃取,色谱法(参见无机化学吧)
8.2 元素分析
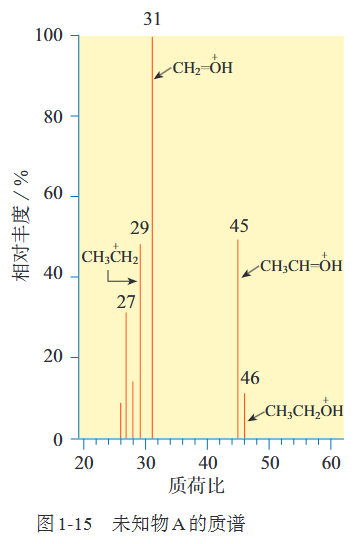
8.3 相对原子质量的确定(质谱法)
用高能粒子轰击样品分子使之成为带正电荷的分子离子与碎片离子.
【注】高中阶段直接看最右边一条得出相对分子质量即可
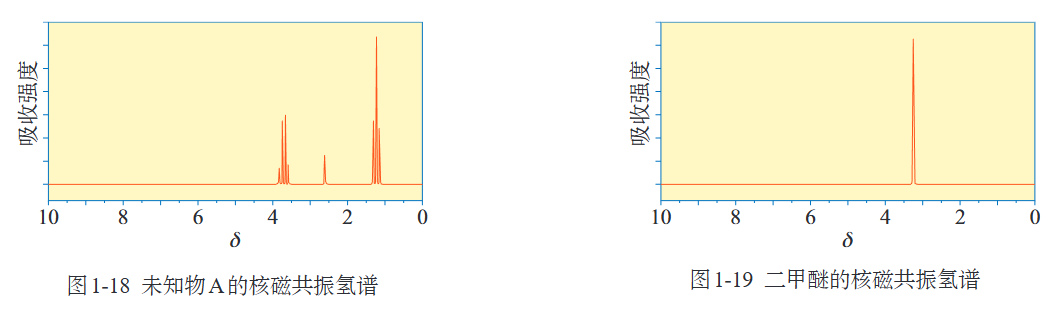
比如由图可知未知物A相对分子质量为46
8.4 分子结构鉴定
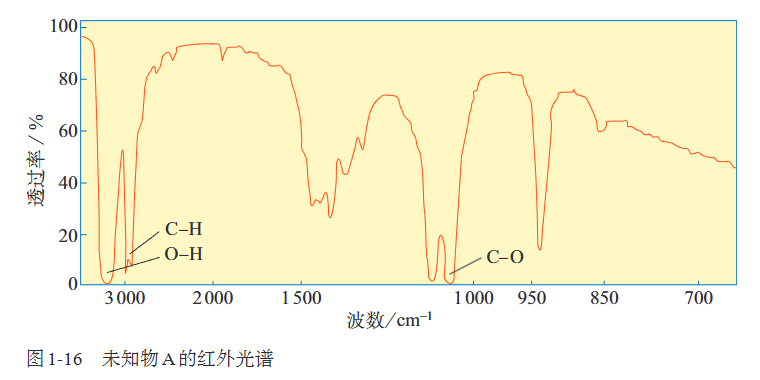
(1)红外光谱
不同的官能团吸收的频率不同,比如下图可知未知物A(乙醇)中含有氢氧键、碳氢键、碳氧键.
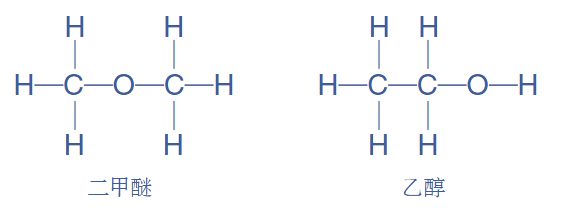
(2)核磁共振氢谱
不同原子共振时吸收的电磁波频率不同,比如下图中未知物A(乙醇)含有三种不同环境的氢原子,比例(吸收峰面积比)为2:1:3,二甲醚中只有一种环境的氢原子.
9.有机物的燃烧规律
xC+xO2→xCO2yH+y4O2→y2H2OCxHy+(x+y4)O2点燃⟶xCO2+y2H2OCxHyOz+(x+y4−z2)O2点燃⟶xCO2+y2H2O【注】计算体积时,注意水是气态还是液态
耗氧量规律:
①等物质的量有机物燃烧
分子组成相差(CO2)m或者(H2O)n的有机物燃烧耗氧相同.
烃中(x+y4)越大,消耗氧气越多
②等质量有机物燃烧
因为1g氢元素消耗14g氧气、1g碳元素消耗112g氧气,所以氢元素消耗氧气的效率更大
于是等质量的烃燃烧,氢元素含量高的消耗氧气更多
(二)烷烃
呼…累死我了,这才终于到了烷烃啊….
那么就从甲烷开始吧
1.甲烷——最简单之名的有机始源
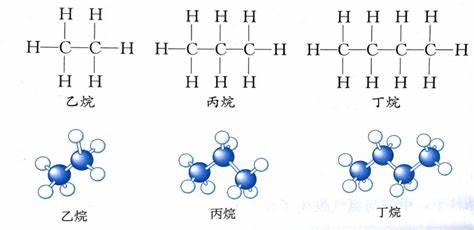
1.1结构
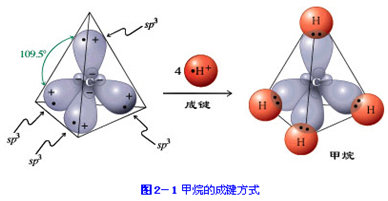
甲烷是正四面体结构,碳原子位于中心,四个氢完全相同,位于四面体四个顶点上.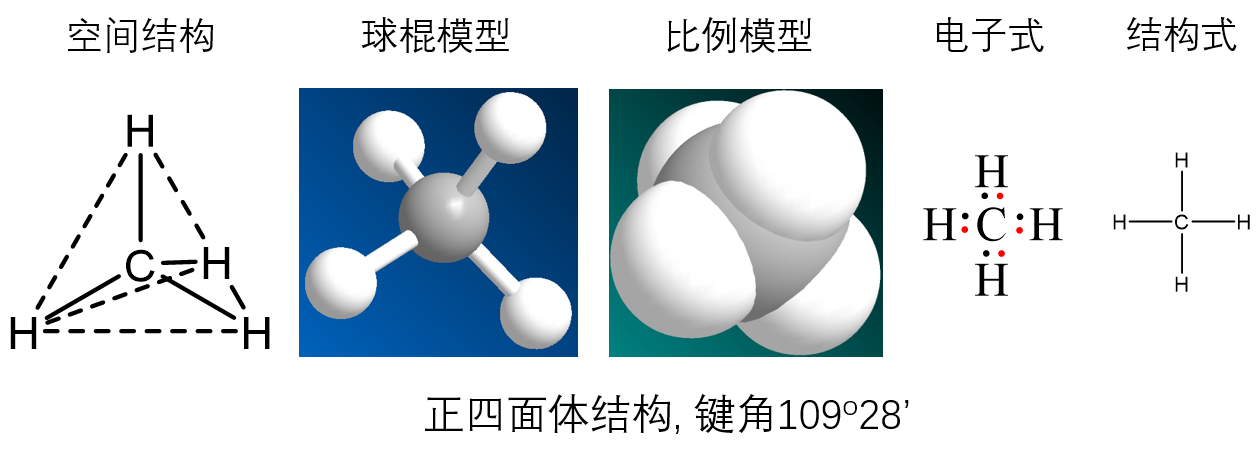
甲烷的碳原子发生sp3杂化,得到四个完全相同的轨道,再与氢原子的1s轨道重合得到甲烷
因为甲烷的二氯代物只有一种结构,所以甲烷的结构不是平面正方形,而是四面体结构.
1.2物理性质
无色无味气体,极难溶于水,密度比空气小
1.3化学性质
(1)可燃性(氧化反应)
注意验纯,现象:淡蓝色火焰
【注】通常情况下甲烷不和强酸、强碱、酸性高锰酸钾反应
(2)取代反应
有机物中某些原子/原子团被其他原子/原子团取代的化学反应.
在光照下有
产物中一氯甲烷为无色气体,其余为无色油状液体
实验: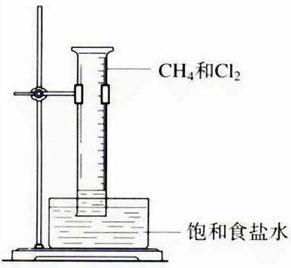
1.试管内液面上升,但不充满试管
2.有白色固体析出,因为氯化氢溶于水电离出氯离子,推动氯化钠的溶解平衡反向进行.
3.瓶壁上产生油状液滴
4.试管中黄绿色逐渐消失
【注】a.取代反应中卤素必须为纯净的单质,氯水、溴水不能发生取代反应
b.反应得到5种产物,与量无关
c.1mol甲烷最多与4mol氯气反应
取代反应中所需卤素原子的物质的量的最大值,等于有机物氢原子的物质的量
d.取代反应的通式:
A−B+C−D⟶A−D+B−C所以一般认为2Na+2C2H5OH⟶2C2H5ONa+H2↑为置换反应
(3)受热分解
隔绝氧气,1500℃以上较完全分解.
1.4制备
C2H5ONa+NaOHΔ⟶Na2CO3+CH4↑1.5用途
燃料:沼气、天然气主要成分
制氯仿(CHCl3)、四氯化碳、炭黑、氟利昂(CHFCl2)、甲醇
【注】甲烷可以作为合成氨的原料(√)
2.烷烃(脂肪烃)
2.1定义
烃指的是碳氢化合物,碳氢两个字年快了就是烃.
烃分子中只以单键结合,其余键全部与氢原子结合的饱和烃(通常指链烷烃,也包括环烷烃)
通式:CnH2n+2,环烷烃通式:CnH2n
2.2物理性质
(1)递变性
碳原子数↑
熔沸点↑ 相对密度↑
【注】a.n=1−4的烷烃呈气态,n≥5呈液态或固态
但是新戊烷在通常情况下呈气态
b.当碳原子数相同时,支链越少,熔沸点越高
如:正戊烷>异戊烷>新戊烷
(2)相似性
难溶于水,易溶于有机溶剂,密度都比水小.
2.3化学性质
(1)氧化反应
都不能使酸性高锰酸钾褪色,都可以燃烧
随着碳原子数量增多,燃烧越来越不充分,有黑烟产生.
(2)取代反应
光照下与卤素反应,生成卤代烃和卤化氢
(三)烯烃、二烯烃
1.乙烯——石油发展的首席代表
1.1来源
石油裂解
乙烯是最简单的烯烃,常用来衡量一个国家的发展水平.
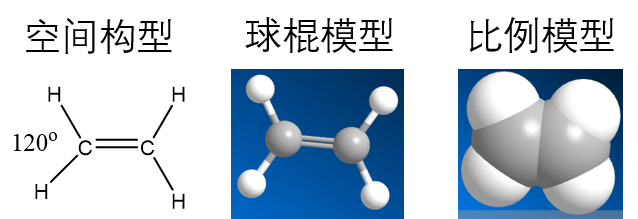
1.2结构


乙烯中的碳原子进行sp2杂化,形成三个完全相同的空轨道.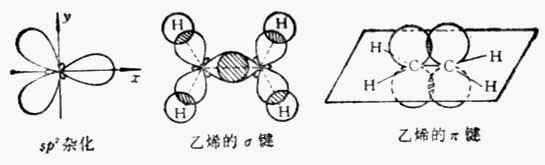
然后,在一个碳原子中,有一个sp2轨道通过σ键结合第二个碳原子的一个sp2轨道,形成双键的其中一个.(中图)
剩下两个sp2轨道与氢的1s结合.
接下来碳原子未杂化的2p轨道相互竖直重叠,结合成π键,形成双键的另一个键.(右图)
所以乙烯分子中含有碳碳双键,由一个σ键和一个π键形成
π键的重叠程度比较小,容易断裂,因此双键是不能旋转的
此外,乙烯分子中的碳氢键完全相等,都在同一平面上.
1.3物理性质
通常乙烯是无色,稍有气味的气体,难溶于水,密度略小于空气,熔沸点低.
【注】实验室常用排水法收集乙烯,不用排空气法.
1.4化学性质
碳碳双键很活泼
(1)氧化反应
a.燃烧(注意验纯)
火焰明亮,伴有黑烟.(燃烧不完全)
b.使酸性高锰酸钾褪色
5C2H4+12KMnO4+18H2SO4⟶10CO2+12MnSO4+K2SO4+28H2O总之
C2H4酸性高锰酸钾⟶CO2【注】a.该反应可以用来检验烷烃和烯烃,但是不能拿来除去烷烃中的烯烃,应该使用溴水.
b.−2C2H4,有机物中氢为正一价.所以加氢为还原反应,失氢为氧化反应.
(2)加成反应(还原反应)
有机物分子中双键/三键两端的碳原子和其他原子/原子团结合生成新化合物的反应.
【注】C=O键断裂也是加成反应.
① CH2=CH2+Br2⟶CH2Br−CH2Br
现象:溴水褪色
产物:1,2-二溴乙烷(无色液体)
【注】a.该反应为乙烯的特征反应,但是需要强调反应比例为1:1.
因为1mol双键和1mol卤素单质反应
1mol三键和2mol卤素单质反应
b.该反应可以用于除去烷烃中的烯烃杂质.
②
CH2=CH2+H2催化剂→ΔCH3CH3CH2=CH2+HCl催化剂→ΔCH3CH2ClCH2=CH2+HBrΔ→CH3CH2BrCH2=CH2+H2O催化剂→ΔCH3CH2OHCH2=CH2+H−OSO3H⟶CH3−OSO3H【注】a. 加成产物纯度大于取代
比如一氯乙烷应用加成制取
b.马氏规则:当不对称烯烃进行不对称加成时,氢更偏向于加在多氢的碳上.
比如:
产物中1CH2Br2CH23CH3较少
c.冷的浓硫酸可以吸收乙烯气体,与之发生加成反应,生成硫酸氢乙酯,所以乙烯不能用浓硫酸干燥
(3)加聚反应
不饱和单体发生加成反应而聚合 成高分子的反应叫加成聚合反应,简称加聚反应。
乙烯分子相互加成形成聚乙烯
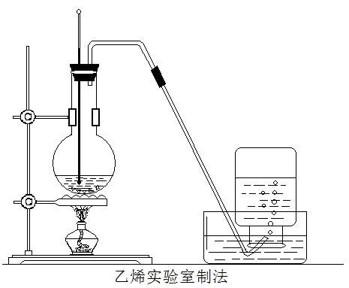
1.5制取
CH3CH2OH浓硫酸→170℃CH2=CH2↑+H2O注意:
a.浓硫酸加入乙醇中,边加边搅拌
b.浓硫酸:催化剂,脱水剂
c.水银球在液面以下,不能触底
迅速加热,防止发生副反应
d.先撤去导管再撤去酒精灯.
e.杂质:碳,一氧化碳,二氧化碳,二氧化硫
②一卤代烃消去法
CH3Ch2Br+NaOH醇→ΔCH2=CH2+H2O+NaBr2.烯烃(单烯烃)
2.1定义
分子中含有一个碳碳双键,其余均为单键的脂肪烃.
是链烃,与碳原子数相同的环烷烃互为同分异构体.
通式:CnH2n(n≥2)
2.2物理性质
(1)n=1−4气体
n=5−18液体
(2)沸点
a.不含支链: 相对原子质量↑, 沸点↑
b.直链>含支链
c.相同碳骨架时,双键靠近中间, 熔沸点↑
d.顺式>反式
(3)沸点,折光率,水中溶解度,相对密度
烯烃>烷烃
2.3化学性质
(1)加成反应
与氢气,卤化氢,卤素单质加成
(2)氧化反应
①燃烧
②与酸性高锰酸钾反应
氧化碳碳双键可以减短碳链.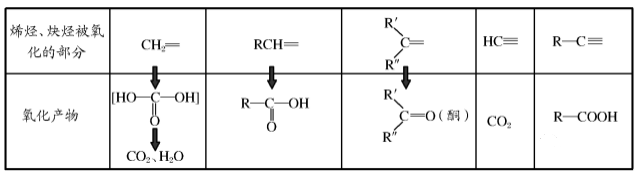

3.二烯烃
3.1 定义
分子中含有两个碳碳双键的链烃,通式:CnH2n−2
3.2 化学性质
当二烯烃发生加成反应时,分为1,2-加成和1,4-加成两种.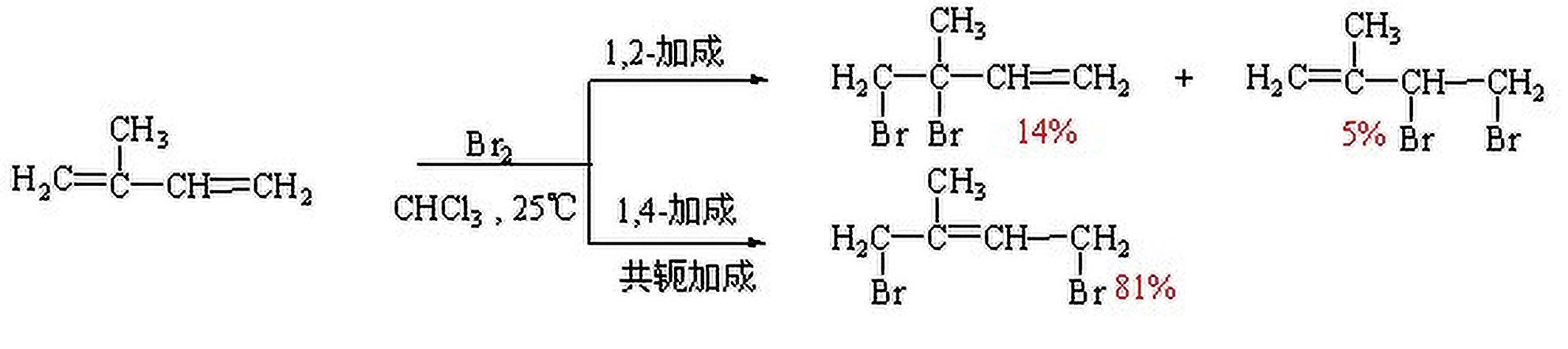
在这个加成反应中,1,4-加成产物是较主要的.
(四)炔烃
1.乙炔——闪烁炔焰间的工业血液
1.1结构

乙炔中的碳原子采取sp杂化,形成两个sp杂化轨道,一个连接另一个碳,一个连接氢原子.剩下两个sp2轨道形成两个相互垂直的π键.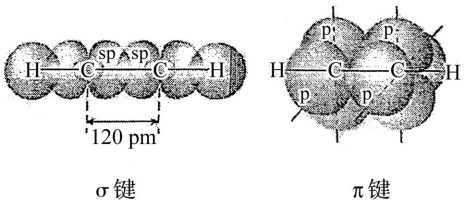
乙炔分子中的三键由一个σ键和两个相互垂直的π键组成,三键比双键更容易断裂,键长也更短.
1.2物理性质
无色、无味的气体,微溶于水,易溶于有机溶剂(废话)
1.3化学性质
(1)氧化反应
①燃烧
②与酸性高锰酸钾反应,生成二氧化碳
(2)加成反应
a.使溴的四氯化碳溶液褪色
1:1(少量溴)
1:2(过量溴)
CH≡CH+2Br2⟶CHBr2CHBr2b.氢气
(略)
c.氯化氢
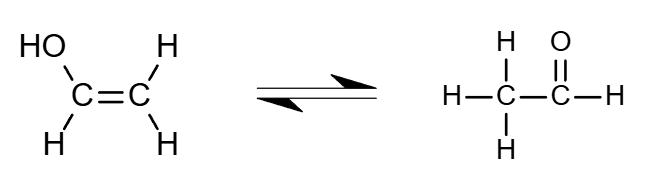
d.水(乙炔水化法制乙醇)
CH≡CH+H2O催化剂→ΔCH3CHO1.4制备
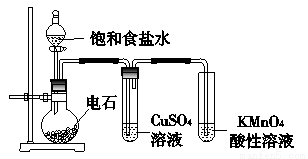
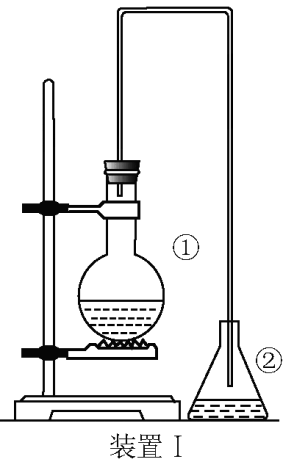
CaC2+2H2O⟶CH≡CH↑+Ca(OH)2注意:
a.实验放出大量热,生成氢氧化钙为浆状物易堵塞,所以不用启普发生器.
b.为了减缓电石与水的反应速率,实验时常滴加饱和食盐水而不直接滴加水.
c.验纯
d.杂质为硫化氢,磷化氢
除杂:用硫酸铜溶液洗气.
若只有硫化氢,用氢氧化钠即可.
2.炔烃(单炔烃)
2.1定义
分子中含有碳碳三键的链烃,通式:CnH2n−2,与碳原子数相同的二烯烃互为同分异构体.
2.2性质
与烯烃相似
(五)芳香烃
1.苯——首尾相连的衔尾蛇
1.1结构
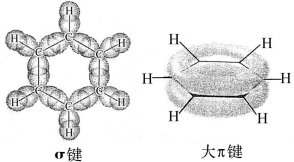
a.苯分子中6个碳原子都以sp2杂化轨道相互重叠,形成6个σ键
每个碳原子又各以一个sp2轨道与氢的1s轨道重叠,形成6个σ键
b.每个碳原子未杂化的2p轨道相互重叠形成一个闭合的π键,大π键平均分布在6个碳原子上,所以苯分子中每个碳碳键强度相等,并不是单双键交替的结构.
【注】证明苯环不是单双键交替结构的证据:
邻二甲苯只有一种结构 , 苯不使溴水或高锰酸钾褪色
1.2物理性质
无色液体,密度比水小
1.3化学性质
(1)氧化反应
燃烧:有浓黑烟(燃烧不充分)
不能使酸性高锰酸钾褪色.
(2)取代反应(易取代难加成)
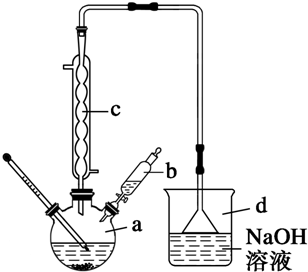
①苯的溴化反应(只发生单取代反应)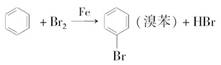
制取溴苯:
现象:a.加入苯和液溴混合物
三颈烧瓶内充满红棕色气体(溴单质)
液体呈现微沸状态(放热)
导管口有白雾出现(HBr)
b.滴加氢氧化钠后,三颈烧瓶(烧瓶)内液体分层.
【注】
a.催化作用的其实是溴化铁
b.长导管作用:
- 导气.
- 冷凝欲挥发的苯与液溴,使其回流.
不插入锥形瓶液面以下:防倒吸.
c.锥形瓶中氢氧化钠(或者换成水):吸收溴化氢
d.溴苯的分离提纯:
- 过滤 : 除去未反应的铁屑
- 水洗后分液 : 除去溴化铁和部分溴化氢
- 碱洗后分液 : 洗去溴化钠,次溴酸钠,氢氧化钠
- 干燥 : 加入无水氯化钙吸水,再过滤
- 蒸馏 : 除去残留的苯
e.只有液溴与苯反应,溴水和溴的四氯化碳溶液不反应.
证明苯的发生的是取代反应而非加成反应: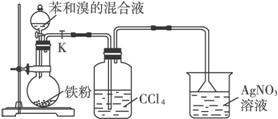
先除去溴单质,再验证溴离子的存在.
(可以在中间检验是否除尽:湿润的淀粉-KI试纸)
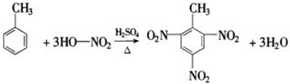
②苯的硝化反应
【注】硝酸可以拆成HO−NO2
反应生成硝基苯:无色油状液体,密度比水大,有苦杏仁味
制备硝基苯: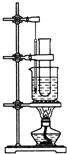
a.向硝酸中慢慢加入浓硫酸并及时摇匀,冷却至50℃以下再加苯.
浓硫酸和其他溶液混合时,将密度小的加入密度大的.
b.浓硫酸:催化剂,脱水剂
c.产物:水洗→碱洗→水洗→干燥→蒸馏
d.用氢氧化钠除去硝基苯中的硝酸
e.可以插入一根长导管:平衡气压,导气,冷凝回流挥发的苯和硝酸.
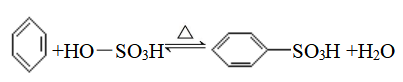
③苯的磺化反应
【注】磺酸基:−SO3H
④苯的加成反应
在Ni做催化剂的条件下,苯能和氢气,氯气加成.
2.多环芳香烃
多苯代脂烃:苯环与脂肪烃相连
联苯:苯环以碳碳单键相连
稠环芳香烃:苯环间共用苯环的若干边
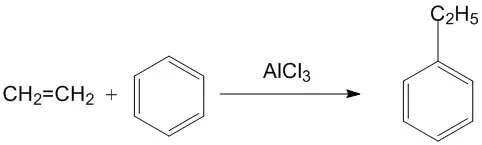
3.苯的同系物
3.1定义
苯环上的氢被烃基取代的产物.
分子中只有一个苯环,侧链全部为烷基.
通式:C6H2n−6(n≥6)
3.2化学性质
(1)相似性
a.燃烧
b.都能和卤素单质,硝酸,硫酸发生取代反应
c.都能和氢气发生加成反应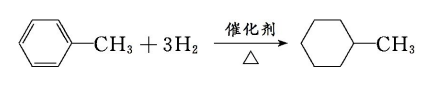
(2)特异性
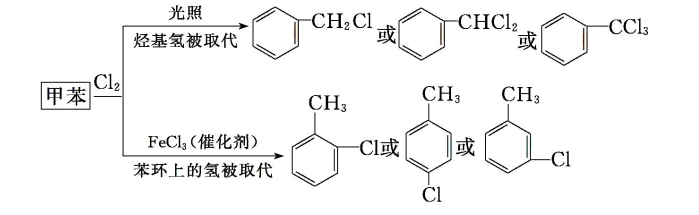
a.苯环上的侧链会使苯环上的氢原子活性增强 : 取代反应
b.苯环也会使烃基碳上的氢原子活性增强 : 氧化反应
条件:与苯环直接相连的碳原子上有氢原子,才能够被酸性KMnO4溶液氧化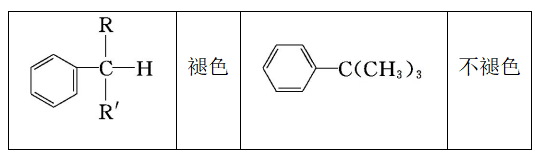
氧化产物:不管烃基碳原子数为多少,都被氧化成“苯甲酸”(即烃基氧化为羧基)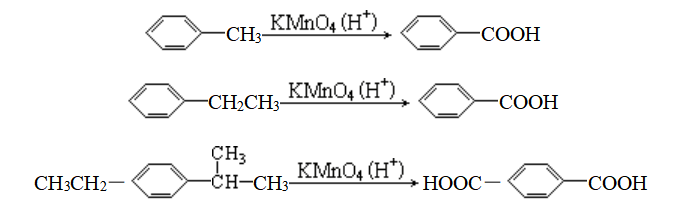
【注】酸性高锰酸钾可以鉴别苯和苯的同系物
但是苯和苯的同系物都不能使溴水褪色.